NOM微生物的氧化还原循环和缺氧氮循环之间存在密切关系,但受分析NOM在氧化还原过程中电子转移通量的方法和技术手段限制,我们无法追踪电子在循环过程中的流通量和流通途径,对其中具体机制和NOM所处的环境生态位的认识是空白的。针对此关键技术方法问题,蒂宾根大学应用地球科学中心Shun Li等研究人员于2020年在Earth-Science Reviews上发表题为“Mediated electrochemical analysis as emerging tool to unravel links between microbial redox cycling of natural organic matter and anoxic nitrogen cycling”研究综述。
受长江流域环境水科学研究公众号邀请,中国地质大学(武汉)袁松虎教授课题组卢钰茜博士对本文进行了解读。
第一部分:内容解读
摘要:天然有机物(NOM)是环境中由多种氧化还原电位的功能组分组成的重要氧化还原活性成分。生物地球化学氧化还原过程中NOM的可逆电子转移和氧化还原性质测定存在多方面阻碍。原因包括用于测定NOM氧化还原状态的反应物有副反应,反应物反应动力学和传统非介导电化学测试慢等。介导电化学分析大大提高了表征NOM氧化还原特性的能力,然而该技术很少被用于研究微生物的可逆氧化还原循环途径,如与厌氧氮(N)循环的耦合。本文综述了近年来介导电化学分析在微生物NOM循环研究中的应用,讨论微生物NOM氧化还原循环与厌氧氮循环的关系,举例说明了介导电化学技术在生物地球化学研究中的潜力。重点讨论了厌氧氨氧化和N-氧化物的减少与N损失和一氧化二氮(N2O)的缓解有关,提出了解决电活性中间体问题的策略。本文提倡使用介导电化学分析来扩大我们对缺氧环境中以NOM为燃料的生物地球化学氮循环的理解,并为该方法在活性N-基团存在下的实验应用提供了建议。
研究背景:主要元素(碳、氢、氮、氧、磷和硫)的生物地球化学循环主要是由微生物介导电子转移来驱动的,其中大部分反应发生在厌氧环境中。NOM在陆地和水生环境中的有机碳储量中占主导地位,微生物介导的NOM氧化还原循环与温室气体(如CH4、N2O、CO2)排放和碳氮循环耦合的氮损失有关,然而由于缺乏测定NOM氧化还原性质的适当方法,导致对这些过程的机制和环境生态位的认识不够。因此,有效的方法跟踪来自和流向NOM的电子转移通量(电子接受和贡献能力,EAC和EDC),对于揭示NOM驱动连接C和N周转的微生物氧化还原反应的进一步过程至关重要。
NOM 是一种有机大分子的巨大混合物,其化学成分、氧化还原活性基团的数量及其氧化还原状态均不同,传统方法通过监测与NOM的氧化还原敏感官能团发生反应的化学氧化和还原剂的浓度和价态变化来评估电子通量,此过程繁琐耗时,且通过特定反应物得到的结果不具普遍性,故传统方法不适用于NOM。在NOM 作为电子供体或受体的微生物过程中,可以通过测定NOM 的电子接受(EAC)和贡献能力(EDC)来定量电子转移通量,但由于NOM结构复杂性和固有的异质性,此方法也一直是一项重大的分析挑战。Sander组评估并改进了一种介导电化学分析方法,以准确量化EAC和EDC以及NOM的总电子交换容量(EEC)。介导电化学分析克服了传统技术的主要缺点,并已成功应用于研究NOM的氧化还原性质和各种生物地球化学氧化还原过程,包括了微生物介导的NOM氧化还原反应,为涉及NOM的生物地球化学过程开辟了新的途径。
由于氮在生物圈中以不同的价态(从+V到-III)存在,并表现出明显的氧化还原依赖形态,因此在无机电子供体和受体缺乏的沼泽等环境中,氮物种很容易与NOM发生氧化还原反应。本文特别强调讨论了介导电化学分析在微生物NOM氧化还原循环的一般特征及其与N循环的相关性。首先综述化学方法在微生物NOM氧化还原循环研究中的应用,其次对比现有的有限文献中使用介导电化学分析来定量微生物NOM氧化还原循环的优势,讨论了介导电化学方法可以用来阐明依赖NO的微生物厌氧氮循环途径中的各种概念(重点是控制氮损失的过程)。最后本文提出了应用介导电化学方法的实验策略,以解决在定量微生物实验或现场样品中NOM的EAC和EDC值时存在电活性物质的干扰问题。
测定NOM氧化还原性质的方法:
(1)化学分析方法(图1):使用氧化和/或还原剂来定量NOM的氧化还原性质,通过测定氧化和还原剂的浓度和价态变化来分别定量NOM的EDC和EAC。最初常使用的氧化剂有FeC6H5O7,K3Fe[CN]6和I2,还原剂有H2S或Zn0。已被广泛应用于表征NOM的氧化还原性质。
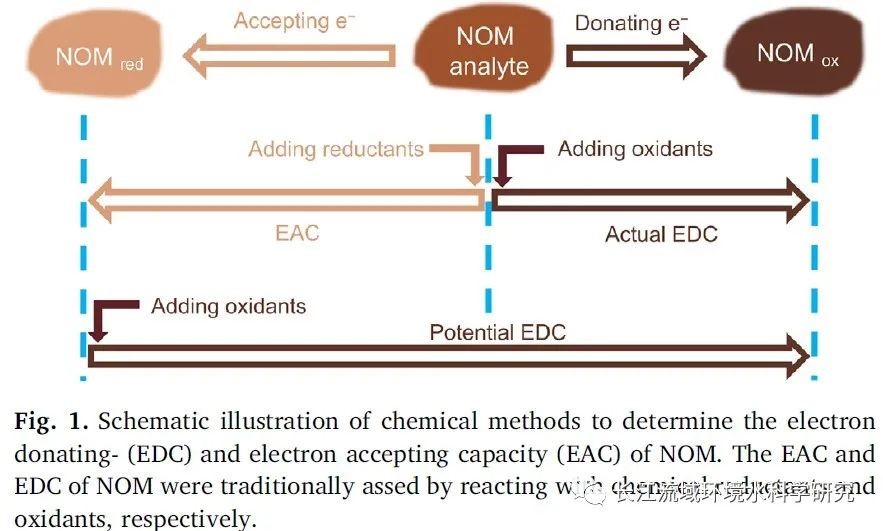
化学方法缺点:①测得的结果不一定反映微生物在实际给定环境中可以转移的电子量(比如,NOM在微生物和金属氧化物中电子穿梭作用通常是通过测定有和无NOM的条件下Fe(III)还原的速率和程度来评估,但实际上NOM的电子关闭作用主要取决于其潜在的EDC);②化学方法中测定反应依赖于pH,无法在测试中应用氧化还原电位;③在反应过程中可能会有副反应和副产物产生,影响EDC和EAC测试的准确性,不适用于解决EDC值的一些微小差异,和测定出NOM中不参与电子穿梭的有机基团
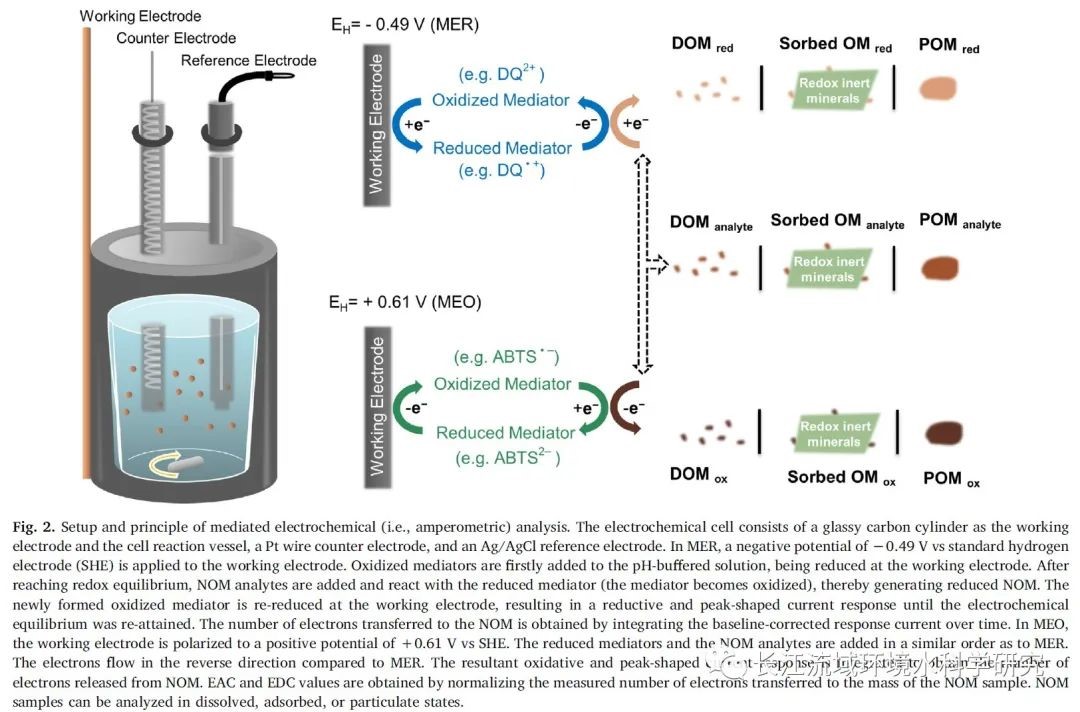
(2)电化学分析方法:使用电极作为电子供体和受体,取代了化学氧化和还原剂,直接通过测定电极上电流变化来测定电子转移通量。但这种直接非介导的电化学测试动力学缓慢,且电极和NOM样品中醌/对苯二酚部分之间的电子转移不平衡,测试依赖于NOM组分与电极表面直接的物理接触,测试灵敏度和准确性不足,不适用于稀释NOM样品或低醌含量样品的测定。
介导电化学法(图2)通过加入少量溶解的氧化还原介质加速了电子在工作电极和分析物之间的转移,缩短了测定时间,克服了直接电化学测定的局限性。介导电化学法已应用于研究溶解HS中质子化与电子转移平衡的耦合,NOM氧化还原反应的可逆性,定量沉积物中颗粒NOM(POM)的氧化还原特性等。这些有限的研究证明了介导电化学分析在实验室和现场样品中直接追踪微生物NOM还原-氧化电子通量的适用性和有效性。
依赖NOM的厌氧氨氧化和N-氧化物还原的生物途径:
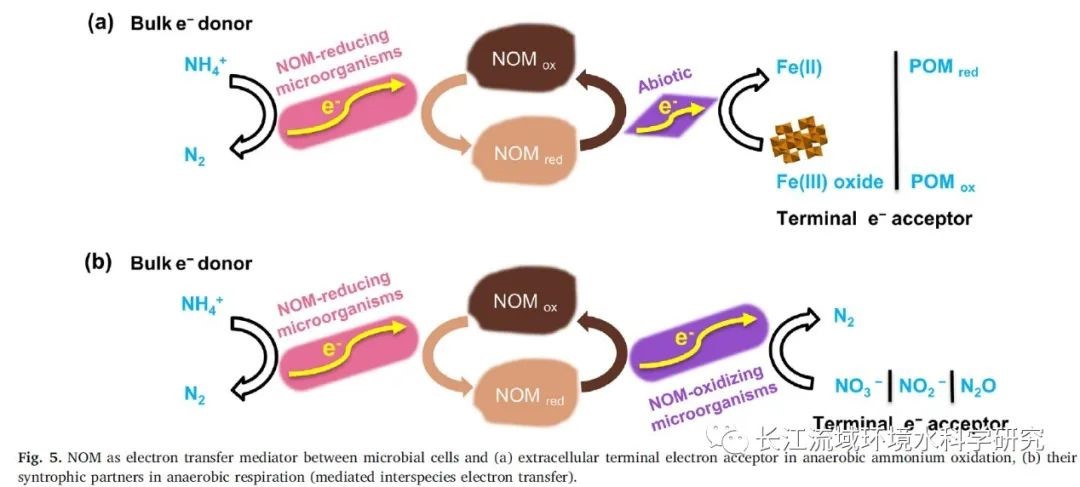
氮流失的厌氧微生物途径包括厌氧氨氧化、完全反硝化、非反硝化N2O还原、NO向N2和O2的氧歧化,前三种是厌氧环境中氮流失的主要途径。在厌氧环境中,微生物介导的NOM氧化还原可以通过不同的电子传递机制与N的损失紧密联系。①NOM可以作为NH4 +氧化为N2的终端电子受体(图3a);②NOM可以作为电子供体,将氧化态氮(NO3-、NO2-或N2O)还原为N2;③NOM可以作为介导Fe(III)-/ NOM-还原的微生物与Fe(III)(氢)氧化物或POM之间的电子穿梭体(图5a)。因此,涉及溶解NOM的微生物氧化还原反应可以通过在Fe(III)或POM的生物还原过程中传递电子来影响N2的生成。④NOM还可能在物种间电子转移中发挥电子载体的作用(图5b)。
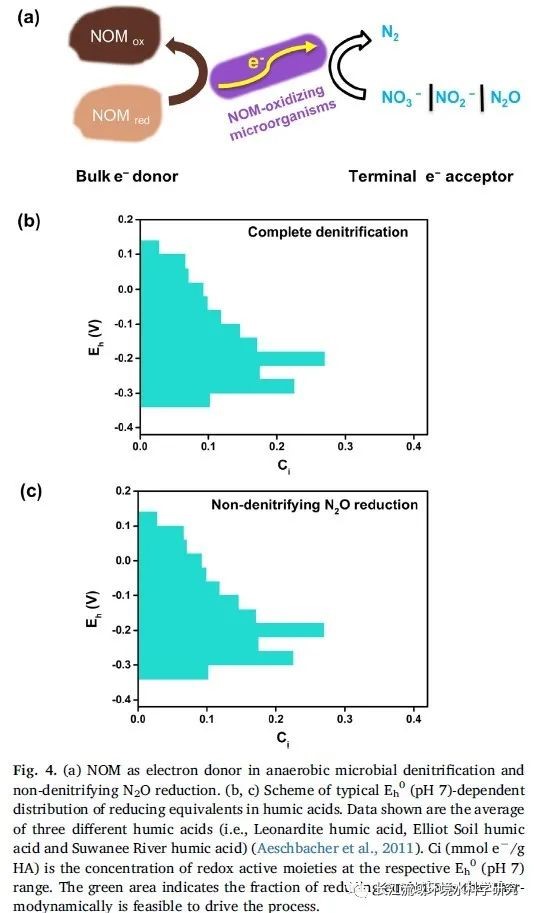
(1)NOM生物还原:由于NOM的氧化还原活性官能团具有异质性,NOM的标准氧化还原电位是一个可变化的范围(+0.15 V~-0.3 V,pH=7)。其可逆还原作用的大部分是类醌类基团,此外还有酚类基团。NOM中氧化还原活性基团在pH=7下的代表电位见图3b和4b。作为对比,表1显示了厌氧N循环中典型的生物地球化学氧化还原偶的还原电位,可以看出,NOM在热力学上能够从微生物厌氧氨氧化中获取电子。

厌氧氨氧化与NOM还原耦合:厌氧NH4+氧化生成N2的无机电子受体包括亚硝酸盐,NO,Fe(III)(氢)氧化物和硫酸盐。由于NOM通常与Fe(III)矿物有关,并且以合适的氧化还原状态存在(图3b),因此它也可能与厌氧氨氧化有关。与Fe(III)(氢)氧化物相比,迄今为止很少有研究有关NOM还原耦合厌氧氨氧化生成N2(图3a)。Zhou等人(2016)证明了可溶的合成氧化还原活性醌类化合物AQDS在Fe(III)(氢)氧化物中通过增强N损失以发挥电子穿梭的作用。这些结果有力地表明,微生物醌还原与厌氧氨氧化和Fe(III)矿物对对苯二酚的非生物再氧化是耦合的(图5a)。近期有研究报道在电化学装置中使用电极作为电子受体,生物氨氧化生成N2,但是对于依赖NOM酶促反应的厌氧氨氧化生成N2机理认识不足。由于不同来源的NOM具有不同的还原电位,其驱动依赖NOM的厌氧氨氧化能力可能因来源和氧化还原状态的不同而不同。
(2)NOM生物氧化:多酚和对苯二酚被认为是NOM中主要的给电子基团,还原态的NOM有可能被微生物氧化,并与氮氧化物(如硝酸盐、亚硝酸盐和N2O)的还原结合,从而影响N2O的形成或消耗,并最终损失活性氮。可逆的NOM氧化结合非反硝化的N2O还原对所有可能的NOM氧化还原状态都是有利的(图4c)。但目前尚不清楚是否存在非反硝化的N2O还原剂,并有助于N2O的还原。依赖N2O的生物AH2QDS氧化与N2O/N2电对的高氧化还原电位(Eh0(pH=7)=+1353 mV)表明N2O可能是酶催化NOM氧化过程中一个高度竞争的终端电子受体。
(3)NOM的电子穿梭:除了直接耦合到缺氧氮循环外,可逆的微生物NOM氧化-还原还可以间接耦合到氧化还原敏感金属Fe、Mn的循环,从而调节氮的损失。目前的研究中,NOM从Fe(III)(氢)氧化物穿梭到N2的可行性仅得到了AQDS(非吸附型的醌)穿梭能力的支持。固相NOM还原可能与厌氧氨氧化结合,溶解性NOM在NOM呼吸微生物和远距离电子受体POM之间穿梭电子。此外,NOM的电子穿梭活性在很大程度上取决于其氧化还原电位,特别是NOM与氧化矿物的吸附会改变NOM和氧化矿物的表面化学和氧化还原性质,进而影响NOM的电子穿梭活性。然而,广泛覆盖氧化还原电位的NOM有望普遍有效地介导各种Fe(III)和Mn(IV)矿物以及具有不同还原电位POM的电子转移。
(4)NOM介导的种间电子转移:种间电子转移使不同微生物物种在厌氧条件下交换还原当量。HS已经作为微生物胞外电子转移中的电子穿梭体被广泛研究,然而在微生物种间电子转移中发挥的潜在作用,以及类似于可溶性蒽醌AQDS增强种间电子转移的机制方面,目前研究较少但却很重要。N2O驱动的厌氧氨氧化生成N2的途径在热力学上是可行的,但与NO依赖厌氧氨氧化生成N2的途径相比,迄今为止还没有实验证明。然而结合前面讨论,依赖于NOM的厌氧氨氧化到N2和NOM耦合的完全反硝化或非反硝化N2O还原过程,在热力学上是可行的。这里假设,可以通过NOM介导种间电子转移,与完全反硝化菌或非反硝化N2O还原剂交换电子的厌氧氨氧化谱系。深入研究这些途径可能会加深我们对缺氧环境中微生物氮循环相互关系的理解。
解决方法应用的局限性:消除电活性物质干扰
尽管介导电化学分析在阐明和量化微生物代谢途径方面具有潜力,涉及厌氧N循环中可逆的电子转移到NOM或从NOM转移电子过程,但该技术也有一定的局限性。例如,其他电活性物质的存在可能会干扰NOM的EAC和/或EDC的测定等。这里对具体实验中出现的局限性进行讨论,并提出可能的解决方法。
还原剂存在(特别是半胱氨酸和硫化氢):介导电化学分析测定NOM时,应尽量减少甚至避免添加半胱氨酸或硫化氢。这些化合物可以起到电子穿梭的作用,并可能触发种间电子转移和电子穿梭,引起MEO分析测试时电流信号的响应,干扰介导电化学测试。
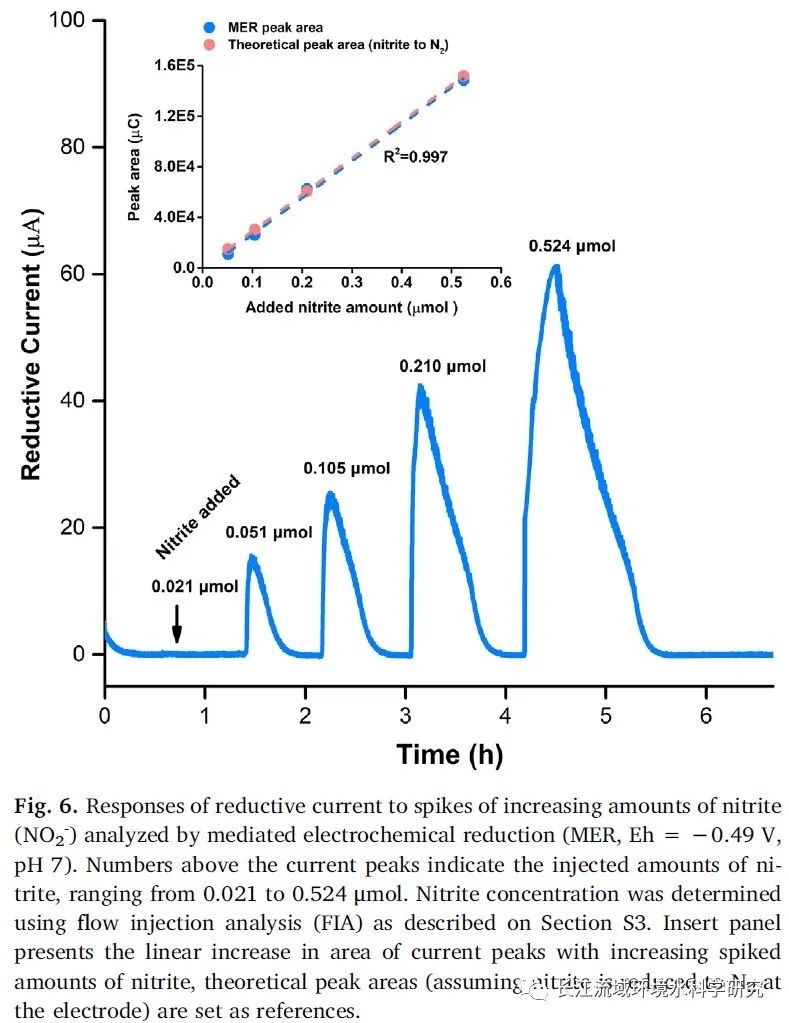
亚硝酸盐存在:亚硝酸盐在MER中具有电活性,会干扰介导电化学分析评估NOM的氧化还原性质(图6)。对于颗粒状(被矿物吸附或作为颗粒)的NOM样品,可以通过厌氧离心去除样品中的含亚硝酸盐的上清液,将固体NOM重新悬浮在新鲜的碱性介质或缓冲溶液中。对于含有溶解NOM的样品,建议预处理步骤选择性地去除培养液中的亚硝酸盐,而不影响溶解NOM的氧化还原特性。另外,氨基磺酸可用于去除NOM中的亚硝酸盐,但若分析体系中存在其他电活性物质(如硫代硫酸盐),需谨慎使用氨基磺酸法。还有生物预处理和氨化剂等也可用于去除亚硝酸盐。
NOM呼吸微生物细胞存在时:不确定细胞是否具有电活性,需要在测试过程尽可能使用无细胞滤液、全细胞悬浮液和洗涤过的细胞悬浮液。
第二部分:贡献解读
背景问题:NOM微生物的氧化还原循环和缺氧氮循环之间存在密切关系,但我们对其中具体机制和NOM所处的环境生态位的认识是空白的,主要是由于无法追踪电子在循环过程中的流通量和流通途径,受NOM结构和性质复杂性影响,没有合适测定NOM在氧化还原过程中电子转移通量的方法和技术手段。本文作者从介导电化学分析溶解态有机质的氧化还原性质中获得了灵感,综述现有的有限研究,对比了天然溶解态有机质研究中介导电化学法和传统化学法的优势,阐述了介导电化学法在揭示NOM微生物的氧化还原循环和缺氧氮循环间关系的适用性和有效性。
核心结论:介导电化学分析的应用可以跟踪微生物和非生物氧化还原过程中可逆的电子通量,然而在探索厌氧环境中微生物驱动的NOM氧化还原循环和N循环之间的联系方面,介导电化学分析仍然是一个未充分利用的工具。介导电化学分析有望成为生物地球化学中研究NOM与N循环之间的氧化还原耦合以及其他NOM氧化还原过程的重要工具。
原文来源:Li., et al., Mediated electrochemical analysis as emerging tool to unravel links between microbial redox cycling of natural organic matter and anoxic nitrogen cycling., Earth-Science Reviews., 2020, 208: 103281 doi.org/10.1016/j.earscirev.2020.103281.
本文由中国地质大学(武汉)生物地质与环境地质国家重点实验室袁松虎教授课题组博士生卢钰茜解读。受作者能力所限,本文难免有不当之处,敬请各位读者谅解。如疑义、建议或其他方面的学术交流,请于袁松虎教授联系,邮箱yuansonghu622@cug.edu.cn.